Robot odhaluje vnitřní fungování mozkových buněk
Přístup k vnitřnímu fungování neuronu v živém mozku nabízí řadu cenných a užitečných informací: vzorce průběhů jeho elektrických aktivit, jeho tvar, čí dokonce jeho genetický profil, vypovídající o tom, jaké geny jsou v daném okamžiku zapnuté. Dosáhnout takovýchto záznamů je nicméně nadmíru přepečlivý úkol považovaný spíše za určitou formu umění, které je tak obtížné zvládnout, že se mu z těchto důvodů na světě věnuje jen hrstka laboratoří.
Výzkumníci vytvořili robotickou paži, která dokáže automaticky zaznamenávat informace z útrob neuronů.
To se ale může brzy změnit: Vědci z MIT a Georgia Institute of Technology vyvinuli způsob, jak proces hledání a uchování informací z neuronů živého mozku zautomatizovat. Ukázali, že robotická ruka vedená počítačovým algoritmem může identifikovat a pořizovat záznamy z neuronů živých myší s lepší přesností a rychlostí než lidský experimentátor.
Nový automatizovaný proces eliminuje potřebu několikaměsíčního tréninku a poskytuje informace o činnosti živých buněk, jejichž získávání jinak vyžaduje značné úsilí. Pomocí této techniky by vědci mohli klasifikovat tisíce různých typů buněk, které se v mozku nacházejí, mapovat, jak jsou vzájemně propojené, a zjišťovat, jak se nemocné buňky liší od normálních.
Projekt je výsledkem spolupráce mezi laboratoří Ed Boydena, docenta biologického inženýrství a mozkových a kognitivních věd na MIT, a laboratoří Craiga Foresta, odborného asistenta na George W. Woodruff School of Mechanical Engineering při Georgia Tech.
Náš tým byl od začátku interdisciplinární, což nám umožnilo přenést principy konstrukce přesných strojů na studium živého mozku,
říká Craig Forest. Jeho postgraduální student, Suhasa Kodandaramaiah, který poslední dva roky strávil jako hostující student v laboratoři Ed Boydena, je hlavním autorem studie, která se 6. května 2012 objevila ve vydání časopisu Nature Methods.
Metoda může být zejména užitečná při studiu mozkových poruch jako je schizofrenie, Parkinsonova choroba, autismus a epilepsie. Molekulární popis buňky doplněný o jejich elektrické vlastnosti a vlastnosti obvodů zůstává ve všech uvedených případech stále těžko pochopitelný. Pokud bychom dokázali opravdu popsat, jak onemocnění mění molekuly ve specifických buňkách uvnitř živého mozku, mělo by nám to umožnit nalézt lepší cíle pro působení pomocí léků.
říká Ed Boyden, který je členem Media Lab a McGovern Institute for Brain Rersearch při MIT.
Dokázali jsme přenést principy konstrukce přesných strojů na studium živého mozku.
reklama
Automatizace
Kodandaramaiah, Boyden a Forest se pustili do automatizace 30 let staré techniky známé jako whole-cell patch clamping tedy něco jako celobuněčné flastrové upínání, která zahrnuje přivedení miniaturní duté skleněné pipetky do kontaktu s povrchem buněčné membrány neuronu, otevření malého póru v membráně a zaznamenání elektrické aktivity uvnitř buňky. Osvojení této dovednosti trvá postgraduálním studentům obvykle několik měsíců.
Kodandaramaiah si manuální techniku patch-clamp osvojoval nejméně čtyři měsíce. Když jsem se v tom nakonec stal dostatečně dobrý, začal jsem tušit, že přes obrovskou obtížnost hraničící téměř s jistou formou umění, by se celý proces mohl zredukovat na řadu stereotypních úkolů, které by mohly být vykonávány pomocí robota,
říká Kodandaramaiah.
Za tímto účelem Kodandaramaiah a jeho kolegové postavili robotickou paži, která skleněnou pipetu do mozku anestetizované myši spouští s přesností na mikrometry. Tím jak se pipeta pohybuje, sleduje elektrickou impedanci tedy to, jak obtížné je pro elektřinu pipetou procházet. Nejsou-li v okolí žádné buňky, elektřina resp. elektrický proud pipetou protéká a impedance je nízká. Narazí-li hrot na buňku, nemůže elektřina proudit tak dobře a impedance se zvyšuje.
Robotická pipeta postupuje po dvoumikrometrových krocích a měří přitom impedanci 10 krát za sekundu. Jakmile detekuje buňku, může okamžitě zastavit a předejít tím propíchnutí membrány. To je velký pokrok oproti dřívější manuální metodě, při které k poškození membrány docházelo téměř pokaždé. Toto je něco, co robot dělat může, ale člověk ne,
říká Boyden.
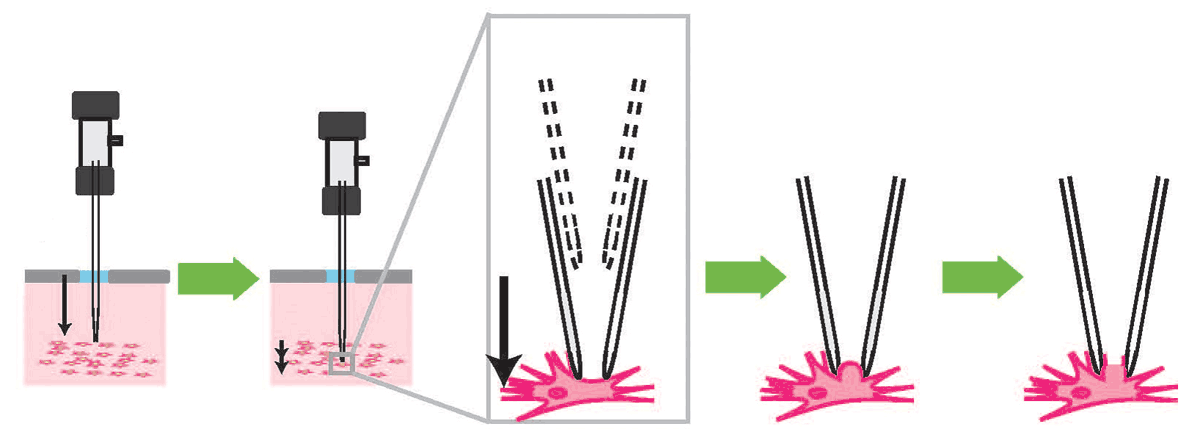
Po detekování buňky zahájí pipeta sání. Díky mírnému podtlaku pak dojde k utěsnění malé plošky buněčné membrány tzv. patche pod dutým hrotem pipety. Toto utěsnění umožňuje elektricky izolovat měřené potenciály a poskytuje také určitou mechanickou stabilitu. Pak může elektroda uvnitř pipety proniknout membránou a zaznamenávat elektrickou aktivitu uvnitř buňky. Robotický systém může detekovat buňky s 90% přesností a ustanovit spojení s detekovanými buňkami po přibližně 40% času.
Vědci také ukázali, že jejich metoda může být využita k určování tvaru buněk tak, že pomocí mikropipetky, která je dutá, vstřikovali do vnitřku buňky barvivo. Dále pracují na využití robotické mikropipetky k odebírání vnitřního obsahu buněk, díky čemuž by se dal číst jejich aktuální genetický profil.
Nová éra pro robotiku
Výzkumníci věří v komerční úspěch nové metody. Nedávno proto založili start-up firmu pod názvem Neuromatic Devices. Jejich robotická paže je také podrobněji popsána na stránce autopatcher.org.
V současné době pracují na navýšením počtu elektrod, aby bylo možno nahrávat více neuronů současně, což by potenciálně umožnilo zjišťovat, jak jsou různé části mozku propojeny.
reklama
S dalšími spolupracovníky se pustili také do klasifikace tisíců různých typů neuronů, které se v mozku nacházejí. S pomocí nové robotické sondy by toto třídění neurony identifikovalo nejen podle jejich tvaru, což je zatím nejčastější způsob klasifikace, ale také podle jejich elektrické aktivity a genetického profilu.
Chcete-li opravdu vědět, co je neuron, můžete se podívat na jeho tvar. Můžete se podívat, jak pálí (jaké generuje průběhy akčních potenciálů). A když z něj pak vytáhnete ještě genetickou informaci, můžete opravdu vědět, co se děje,
říká Craig Forest. Teď už víte všechno. To je celý obraz.
Boyden zase věří, že toto je jen začátek využití robotiky v neurovědách ke studiu živých zvířat. Robot jako tento může být potenciálně využit k podání léků pomocí infuze na přesně určené místo v mozku nebo k dodávce vektorů pro genovou terapii. Doufá také, že jejich robot bude neurovědce inspirovat k vytváření dalších druhů robotické automatizace, jako například v optogenetice, kde by se využitím světla mohly cíleně rušit určité neurální obvody a díky tomu pak odhalovat jakou úlohu tyto obvody hrají ve vyšších mozkových funkcích.
Optogenetika
Optogenetika kombinuje optické a genetické metody k rychlému a reverzibilnímu ovládání neurálních aktivit případně i jiných buněčných funkcí.
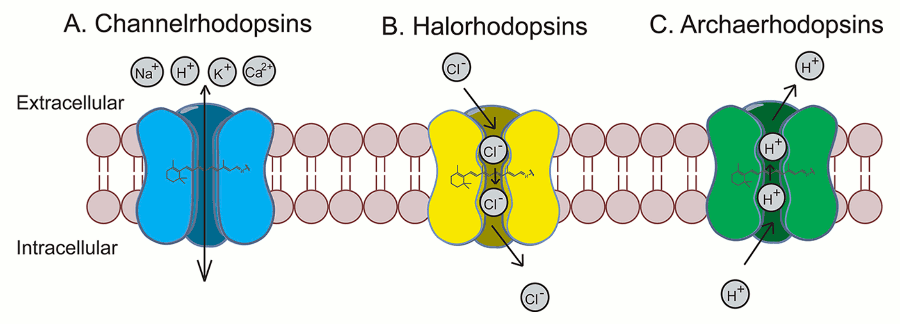
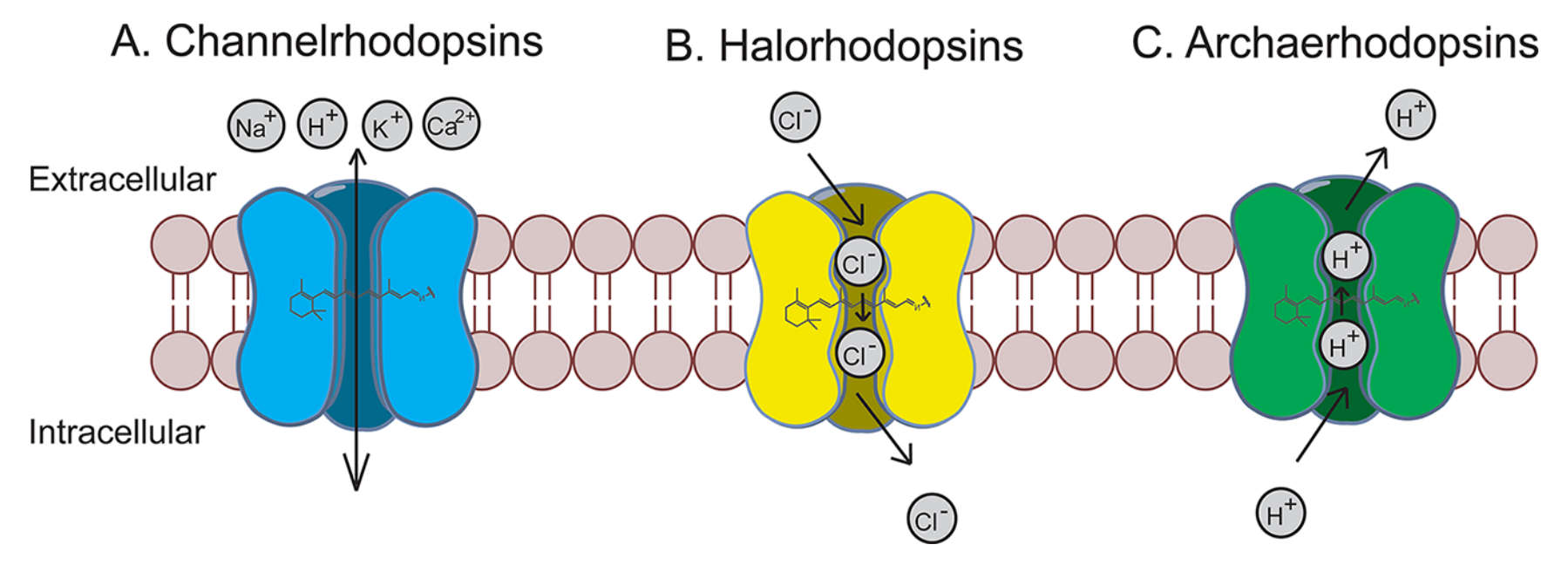
V roce 2002 byl v buněčné membráně zelených řas objeven protein, který při působení světla vytvoří v membráně kanál, jímž se dovnitř buňky dostanou pozitivní ionty a je tak vyvolán nervový vzruch. Zmíněný protein se nazývá channelrhodopsin zkráceně ChR2 a výzkumníkům se ho pomocí genetických metod v roce 2005 podařilo vpravit do membrán savčích buněk včetně neuronů.
Jiné proteiny takzvané opsiny mají při působení světla opačný efekt. Halorhodopsin získaný z archaebakterie Natronomonas pharaonis se chová jako pumpa, která dovnitř buňky čerpá záporné ionty. Archaerhodopsin zase odčerpává pozitivní ionty z buňky ven.
Tyto opsinové proteiny mohou být pomocí genetických modifikací snadno exprimovány ve specifických buňkách a použity v mnoha modelových organismech od háďátek, přes hlodavce, až po primáty či lidskou oční sítnici.
K stimulaci neurální aktivity je sice možné využít i určitých chemických látek nebo elektrod. Nicméně elektrická stimulace není tak prostorově přesná a chemikálie zase působí příliš pomalu. Díky světlu je možné pracovat až se stovkami pulsů za sekundu. A díky genetice cílit pouze na specifické buňky.
Optogenetiku lze využít jak in vitro (Petriho misky, zkumavky) tak in vivo, tedy na živých modelech. Optogenetické nástroje přináší zcela nové možnosti zkoumání neurálních procesů a chování a posouvají výzkum mozku o několik řádů dále.
The Genom Project, tedy projekt čtení lidského genomu byl proveden lidmi a obrovským počtem robotů, kteří všechno to sekvenování provedli. V syntetické biologii či řízené evoluci roboti odvádějí velkou část molekulární biologie. Také v jiných oborech biologie jsou roboti nezbytní. Neurovědy jsou jednou z mála oblastí biologie, ve které roboti mají teprve dosáhnout významného vlivu,
říká na závěr Ed Boyden.
K dalším spoluautorům patří postgraduální student MIT Giovanni Talei Franzesi a postdoc Brian Y. Chow.
Vývoj nové technologie byl financován především z prostředků the National Institutes of Health, the National Science Foundation and the MIT Media Lab.
Zdroje a odkazy
Automated whole-cell patch-clamp electrophysiology of neurons in vivo nature.com
Robot reveals the inner workings of brain cells gatech.edu
Robotic probes plumb brain's circuitry eetimes.com
New Automated Process Dissects Inner Mechanics of Neurons in the Brain dailytech.com
Neuromatic Devices odkaz na stránky firmy, kterou výzkumníci založili
Autopatcher.org: In Vivo Robotics, for Automatic Recording of Neurons in the Live Brain podrobné produktové a metodické informace k automatické paži